НЕТРАДИЦИОННЫЕ ОКИСЛИТЕЛЬНЫЕ РЕАГЕНТЫ
В 1993 году научная группа лаборатории химической кинетики ИОХ УНЦ РАН, возглавляемая В. В. Шерешовцом, была преобразована в лабораторию окислительных процессов. Задачи лаборатории - разработка новых высокоэффективных окислительных реагентов; исследование продуктов, кинетики и механизмов окислительных превращений с целью выявления приемов управления селективностью процесса окисления; совершенствование методов окислительной функционализации органических соединений.
Научный потенциал новой лаборатории заложен работами В. В. Шерешовца, Н. Н. Кабальновой, Н. М. Андрияшиной, проводимыми под руководством д.х.н. В. Д. Комиссарова. Итогом периода становления лаборатории можно считать докторскую диссертацию В. В. Шерешовца “Реакции
органических триоксидов“ (1992 г.). В этой работе обобщены результаты исследований по химии нестабильных пероксидов (гидротриоксидов, озонидов фосфитов, комплексов озона) – направления, ставшим одним из приоритетных для лаборатории. За период её существования опубликовано более 50 статей в отечественных и зарубежных научных журналах. Три сотрудника лаборатории (Д. В. Казаков, 1997 г.; А. Ф. Хализов, 1997 г.; Е. В. Авзянова, 1998 г.) защитили кандидатские диссертации. Научные достижения последних лет стали основой докторской диссертации С. Л. Хурсана “Органические полиоксиды” успешно защищенной в 1999 году. Наряду с исследованием полиоксидов в последние годы получили развитие исследования, связанные с окислительными превращениями с участием озона, молекулярного кислорода, синглетного молекулярного кислорода, диоксида хлора, гипохлоритов. Результаты указанных выше работ представлены в настоящей статье.ОРГАНИЧЕСКИЕ ПОЛИОКСИДЫ
Выполнены эксперименты по синтезу и идентификации более пятидесяти новых триоксидов (комплексов О
3, гидротриоксидов, диалкилтриоксидов, озонидов моно- и полифосфитов), различающихся по характеру связи О3 в аддукте и строением органического радикала. В основе их получения лежат реакции низкотемпературного озонирования1-5:![]()
![]()
![]()
![]()
![]()
Низкотемпературным озонированием на поверхности силикагеля получены неизвестные ранее гидротриоксиды углеводородов.
Детально изучены термодинамические, кинетические закономерности образования АгХ
Ч О3, ROOOH, ROOOR, (RO)3PO3 и кинетика их брутто-распада; измерены константы скорости распада и активационные параметры; определены константы устойчивости, энтальпии и энтропии образования комплексов О3 с рядом монозамещенных бензолов; выявлено, что константы скорости разложения аддуктов озона и константы равновесия подчиняются уравнениям Гаммета, Тафта, Кабачника; влияние растворителя на кинетику брутто-распада ROOOH и (RO)3PO3 описывается четырёхпараметровым уравнением Коппеля-Пальма; карбоновые кислоты и амины катализируют разложение ROOOH и (RO)3PO3. Обнаружен и детально исследован индуцированный распад ди-(трет.бутил)триоксида1-20.Методами ХЛ и ЯМР, а также квантовохимическими расчетами изучена ассоциация гидротриоксидов. Для
ROOOH спиртов характерным является образование шестичленных комплексов с внутримолекулярной водородной связью. Гидротриоксиды углеводородов ассоциируются в прочные димерные комплексы, либо взаимодействуют с растворителем. Эти процессы обусловливают компенсационный эффект, характерный для термораспада гидротриоксидов различного строения21 (работа выполнена при участии лаборатории спектральных методов ИОХ УНЦ РАН, к.х.н. Л. В. Спирихин)Установлено, что разложение AгX
Ч O3, ROOOH , ROOOR, (RO)3PO3 сопровождается интенсивной хемилюминесценцией в видимой и ИК-области, выявлены спектральный состав свечения и эмиттеры излучения (работа выполнена совместно с лабораторией химической физики ИОХ УНЦ РАН, чл.корр. РАН В. П. Казаков). Предложен метод определения констант скорости распада триоксидов, основанный на изучении кинетики затухания свечения1-4, 6, 7, 11, 16, 20, 23-26 .Методом ЭПР с применением спиновых ловушек изучена генерация свободных радикалов при термолизе гидротриоксидов спиртов, эфиров, ацеталей, альдегидов; определена доля радикального распада; показано, что эта доля зависит от природы
ROOOH, температуры; зависимость константы скорости радикального распада от природы растворителя подчиняется уравнению Коппеля – Пальма. Исследовано образование свободных радикалов при термическом распаде ди(трет.бутил)триоксида. Показано, что ди(трет.бутил)триоксид является эффективным инициатором цепного разложения озона.![]()
Предложен метод получения тетроксидов (
ROOOOR) из триоксидов:Получены количественные характеристики образования и распада
ROOOOR2, 27 (работа выполнена совместно с лабораторией спектральных методов ИОХ УНЦ РАН)Определен выход
1О2 при разложении гидротриоксидов, диалкилтриоксидов и озонидов моно- и полифосфитов. Рассмотрено влияние строения триоксида, температуры, природы растворителя и катализаторов распада на выход 1О2; предложен метод определения констант скорости тушения 1О2, основанный на тушении ИК-ХЛ, возникающей при разложении триоксидов1, 7, 21, 22, 25, 26.Проведено систематическое исследование кинетики и продуктов окисления органических соединений аддуктами озона: алкенов и диенов, вторичных и третичных аминов, фосфинов и фосфитов, сульфидов, сульфоксидов, тиоацеталей, илидов серы; предложены новые реагенты для асимметрического окисления сульфидов - озониды оптически активных фосфитов
1, 17.С привлечением оригинальных квантовохимических методик расчета проанализирована термохимия органических полиоксидов. Рассчитаны энтальпии образования и прочности химических связей (О-О, О-Н, С-О) для широкого ряда ди-, три- и тетроксидов. Проведен термохимический анализ реакций образования и разложения полиоксидов. Показано, что полиоксиды с пятью и более атомами кислорода (пентоксиды и т.д.) крайне лабильны, что обусловлено легкостью гомолитического разложения как самих полиоксидов, так и продуктов их распада – полиоксильных радикалов
28-31.Полуэмпирическим квантовохимическим методом изучен механизм взаимодействия озона с С – Н связью
32.Полученные результаты составляют основу представлений о
химии полиоксидов. Эти данные позволяют выбрать оптимальные условия получения полиоксидов, определить температурные границы их термической устойчивости и эффективность как радикальных инициаторов, источников 1О2 и окислительных реагентов, выявить приемы регулирования скорости образования свободных радикалов, синглетного кислорода, а также проводить целенаправленно окисление конкретных соединений напрямую аддуктами озона либо 1О2, выделяющимся при их разложении. Работа выполнялась в рамках гранта Российского фонда фундаментальных исследований (проект №93-03-05231) и Федеральной целевой программы “Интеграция” (проект 2.1-573).ДИОКСИРАНЫ
Диоксираны – циклические пероксиды:
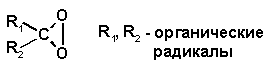
нашли широкое применение в качестве окислительных агентов, характеризующихся высокой скоростью окисления в сочетании с регио-стереоселективностью процесса.
Если окислительная активность диоксиранов по отношению к органическим соединениям различных классов достаточно хорошо изучена, то механизмы реакций с их участием остаются предметом острых научных дебатов. Нами изучен механизм взаимодействия диметилдиоксирана (ДМДО) с насыщенными органическими соединениями. Показано, что в зависимости от природы субстрата окисления реакция протекает либо молекулярно (посредством частичного переноса электрона к диоксирану), либо гомолитически.
Последний процесс осуществляется путем гомолиза связи О-О с последующей атакой связи С-Н субстрата, или в результате бимолекулярной реакции диоксирана и органического соединения23, 33-40.Состав продуктов и их выход при термическом распаде диметилдиоксирана существенно зависят от условий проведения реакции, в первую очередь, от присутствия кислорода в растворе. Термическое разложение в насыщенных кислородом растворах ацетона осуществляется с невысокими скоростями. В инертной атмосфере протекает индуцированное алкильными радикалами разложение ДМДО. Измерена константа скорости взаимодействия алкильных радикалов с диоксираном. В присутствии кислорода термолиз ДМДО представляет собой полностью заингибированный радикальный процесс. Поэтому стехиометрия расходования ингибитора –
O2 и инициатора – ДМДО позволяет определить эффективность инициирования и, таким образом, долю радикальных каналов в реакции ДМДО с насыщенными органическими соединениями33, 35-39.CИНГЛЕТНЫЙ КИСЛОРОД
Полиоксиды являются эффективными источниками синглетного кислорода, что позволяет изучать окислительные превращения с его участием. Реакционную способность различных соединений по отношению к 1О2 исследовали по тушению люминесценции синглетного кислорода в ИК - области спектра1, 2, 7, 22, 25.
Эффективность фенолов как антиоксидантов определяется их устойчивостью по отношению к внешним воздействиям
. Так, от скорости прямого и сенсибилизированного фотолиза фенольных соединений зависит продолжительность их защитного действия. Изучено тушение синглетного кислорода рядом фенолов22, 25, 26. Константы скорости уменьшаются с уменьшением потенциала ионизации. Выполняется линейная зависимость между логарифмом константы тушения 1О2 и потенциалом ионизации тушителя, что свидетельствует от том, что тушение 1О2 протекает по механизму переноса электрона. Обнаружено, что природные флавоноиды, содержащие гидроксильные группы в фенильных кольцах, оказывают эффективное защитное действие от синглетного кислорода22, 25, 26. Изучено взаимодействие синглетного кислорода с глицирретовой кислотой, 2,2,4ў - триоксихалконом (изоликвиритигенином), и их гликозидами - глицирризиновой кислотой и 2,4ў -дигидрокси-4-[2-О-(b -D-апио-D-фуранозил)-b -D-люкопиранозилокси]халконом. Измерены константы скорости взаимодействия 1О2 с d-глюкозой и l-арабинозой. Для гликозидов величина константы на порядок выше, чем для соответствующего агликона. В случае сахаров значения констант близки к константам скорости тушения 1О2 гликозидами. На основании этих данных установлено, что углеводный остаток защищает агликон от синглетной оксигенации ( тушение 1О2 на молекулах углеводов происходит главным образом по механизму физического тушения). Проведено раздельное определение констант скорости химического и физического тушения. Измерены константы скорости взаимодействия синглетного кислорода с производными глицирризиновой кислоты (эфирами, амидами, изоцианатами, изотиоцианатами, уретанами, гликопептидами)25, 26.Изучено окисление широкого ряда диазосоединений
7. Из линейной зависимости константы скорости тушения от потенциала ионизации сделан вывод, что одним из основных факторов, способствующих протеканию данной реакции, является хорошее перекрывание высшей занятой молекулярной орбитали диазосоединений и низшей свободной молекулярной орбитали синглетного кислорода. Выполнено раздельное определение констант скорости химического и физического тушения 1О2 (Работа проводилась совместно с лабораториями ИОХ УНЦ РАН: электронно-молекулярных взаимодействий, д.х.н. И. И. Фурлей; координационой химии, д.х.н. Ю. И. Муринов; тонкого органического синтеза, д.х.н. Ф. З. Галин).МОЛЕКУЛЯРНЫЙ КИСЛОРОД
В лаборатории проводятся исследования окислительной трансформации органических соединений с участием молекулярного кислорода. Совместно с лабораторией тонкого органического синтеза ИОХ УНЦ РАН, д.х.н. Ф. З Галин и ИОХ РАН им. Н. Д. Зелинского г. Москва, академик РАН О. М. Нефёдов разрабатывается технология получения синтетического пиретроида – этофенпрокса - эффективного инсектицидного препарата, перспективного для применения в сельском хозяйстве и в быту:
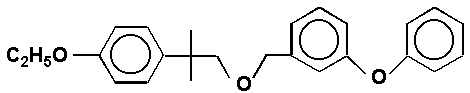
Предложена новая схема синтеза этого соединения, основанная на жидкофазном окислении м- и п-(хлор-трет-бутил)кумолов и превращении полученного гидропероксида в п-(хлор-трет-бутил)фенол
41: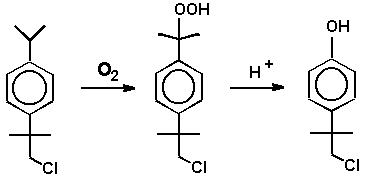
Работа выполняется при финансовой поддержке Государственного комитета РФ по науке и технологиям (проект 04.02.07.06.).
ОЗОН
Химия озона - традиционное направление научных исследований лаборатории. Работа ведется по двум направлениям - озонирование органических соединений нанесенных на сорбент и жидкофазное озонирование органических соединений (целлюлоза, хитозан, полиацетилен, терпеновые углеводороды)
14, 18, 19, 42-48.Исследовано озонирование (+)-3-карен-5-она с целью получения кетокароновой кислоты – полупродукта в синтезе ряда оптически активных пиретроидов
45. Выбраны оптимальные условия проведения процесса (глубина озонолиза, температура, природа растворителя и восстанавливающего агента). Работа выполнена совместно с лабораторией тонкого органического синтеза, д.х.н. Ф. З. Галин.Изучена реакция озона и синглетного кислорода с полиацетиленом
43. Установлено, что кристаллический полиацетилен в отличие от аморфного полиацетилена не подвергается окислению указанными реагентами (совместно с лабораторией радикальной полимеризации, д.х.н. Г. В. Леплянин).Озонирование целлюлозы приводит к ее деполимеризации. При достаточной продолжительности озонирования достигаются значения степени полимеризации, характерные для микрокристаллической целлюлозы, которая широко используется в фармацевтической и пищевой промышленности
42, 44 (работа выполнена совместно с Институтом химии Коми НЦ РАН, д.х.н. В. А. Дёмин).Озонирование водной суспензии хитозана приводит к окислению аминогрупп, сопровождающемуся дезаминированием и сшивкой макромолекул. При защите аминогрупп протонированием кислотами основным процессом является разрыв 1,4-
b -D-глюкозидных связей в макромолекуле. Степень полимеризации продуктов озонолиза в кислой среде можно регулировать в широких пределах условиями реакции. При постоянной концентрации солянокислой соли хитозана в водных растворах эффективная константа скорости расходования озона падает с повышением концентрации электролитов в реакционной среде. Это связано с влиянием ионной силы раствора на изменение конформации макромолекул хитозана46, 47 (работа выполнена совместно с лабораторией стереорегулярных полимеров ИОХ УНЦ РАН, академик РАН Ю. Б. Монаков).ДИОКСИД ХЛОРА И ГИПОХЛОРИТ
Новым направлением для лаборатории являются исследования в области химии диоксида хлора. Диоксид хлора, являясь окислителем средней силы, нашел широкое применение для водоподготовки. Вся Северная Америка и более 100 городов в Европе применяют для этих целей диоксид хлора. Другой крупный потребитель ClO2 – отбелка различных материалов (целлюлоза, ткани и т.д.) Вместе с тем, органическая химия ClO2 изучена недостаточно. Диоксид хлора имеет, на наш взгляд, большие перспективы как окислитель для органического синтеза. Начаты систематические исследования физико-химических закономерностей реакций ClO2 с органическими веществами в различных средах.
Обнаружено, что диоксид хлора в органических средах окисляет вторичные амины пиперидинового и имидазолинового рядов с образованием нитроксильных радикалов:
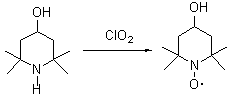
В свою очередь, нитроксильные радикалы образуют с диоксидом хлора комплексы, которые превращаются в оксоаммониевые соли:
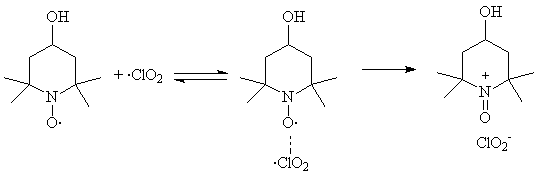
Определены константы устойчивости комплексов с рядом нитроксильных радикалов пиперидинового и имидазолинового ряда
49 (работа выполнена совместно с Новосибирским институтом органической химии СО РАН, академик РАН Г. А. Толстиков).Выявлено сильное влияние растворителя на реакцию диоксида хлора с диоксоланами. В галоидалканах со слабой связью С-Г происходит вовлечение растворителя с образованием галогенсодержащих продуктов (работа выполнена совместно с Уфимским нефтяным техническим университетом).
Весьма интересна реакция диоксида хлора с фуллереном
C60, приводящая к образованию катион-радикала фуллерена C60·+. Процесс имеет сложный характер, о чем говорит аномально высокая стехиометрия ClO2:C60=60:1 а так же хемилюминесценция, сопровождающая реакцию50 (работа выполнена совместно с Институтом элементоорганических соединений РАН г. Москва, д.х.н. В. И. Соколов).В настоящее время в лаборатории проводятся систематические исследования продуктов кинетики и механизма взаимодействия диоксида хлора с органическими и неорганическими соединениями различных классов. Указанная работа поддержана Российским фондом фундаментальных исследований (проект №99-03-33195).
Мощная база по производству гипохлорита натрия в регионе (Химпром г. Уфа, Каустик г. Стерлитамак) обусловила необходимость изучения окислительных процессов с его использованием. Совместно с АОО Салаватнефтеоргсинтез, АОО Уфанефтеоргсинтез проводится работа по применению гипохлорита натрия в процессах утилизации промышленных отходов.
На новом этапе развития лаборатории предстоит дальнейшее расширение указанных направлений. В частности, наряду с изучением нетрадиционных окислительных реагентов, механизмов и интермедиатов окислительных процессов планируется расширение работ, связанных с окислительной функционализацией органических соединений с целью получения практически важных продуктов, полезных для нужд человека. Продолжатся исследования по разработке научных основ утилизации многотоннажных отходов нефтехимических производств.
Литература
94. Химия, химическая технология, экология. – Уфа. – 1994. – С. 33.
1999. - №1. – С. 61.
21. Авзянова Е. В.//Дис. ... Канд.хим. наук.- Уфа, ИОХУНЦ РАН, 1998. –136 с
Муринов Ю. И., Шерешовец В. В.// Известия АН Сер.хим. – 1993. - №12. –
С. 2132.
Толстиков А. Г.//Химико-фармацевтический журнал. – 1995. - №5. – С. 50.